常见FAQ
Q:谁需要根据MoCRA法规提交化妆品注册和产品列名?
A:
1. 企业注册:
生产或加工在美国上市的化妆品的任何企业都被视为注册主体, MoCRA基于“小型企业”(三年内年平均销售额低于100万美元的企业)享有相应的豁免政策。
注意:豁免政策不适用于制造或加工以下化妆品的制造商或企业:
1) 经常接触眼部粘膜的产品(如眼妆类产品等)
2) 注射用的产品
3) 供内服的产品(如牙膏、漱口水等)
4) 改变外观超过24小时并且消费者不需要在通常使用情况下将其移除的产品(如指甲油、染发膏、定型发蜡等)
需要注意的是,如果一个企业为多个责任人生产或加工化妆品,则只需要注册一次。
2. 产品列名注册:
根据《FD&C法案》第609(a)节或《公平包装和标签法案》 第4(a)节,术语“责任人”是指其名称出现在化妆品标签上的化妆品的制造商、包装商或经销商。
“责任人”将负责:
1)化妆品产品列名
2)不良事件报告
3)安全性证实
4)标签以及香料过敏原披露和记录。
Q:MoCRA法规范畴下化妆品FDA企业注册中有责任人和代理人两个角色,这两个角色的责任分别是什么?
A:
1. 责任人(Responsible Person):是将产品引入市场的实体。他们的任务是确保化妆品符合相应的法规和标准,是产品列名提交和更新的主体。他们不一定位于美国,其定义如下:FDCA 604(4) defines a “responsible person” as: The term ‘responsible person’ means the manufacturer, packer, or distributor of a cosmetic product whose name appears on the label of such cosmetic product. Responsible person本身不需要是美国公司,也可以是中国商家或美国买家。在代工场景中 ,responsible person一般是海外买家,因为品牌会最清楚商品成分做listing登记。
2. 美国代理人(US Agent):代理人必须位于美国境内,并在美国设有营业地点且真实运营的。非美国企业在递交企业注册时必须指定一个美国代理人负责与FDA沟通,他们可以全天候为不良事件报告、调查问询、紧急通信等提供服务,是FDA与企业的沟通桥梁。
Q:如何确定所售卖的商品是化妆品还是OTC范畴下“功能型化妆品”?
A:
根据美国法律,许多个人护理产品均作为OTC药品进行监管,例如声称具有以下特性的产品:
1)防晒
2)预防和治疗头皮屑和痤疮
3)头发修复和生长
4)皮肤漂白和美白
5)皮肤和嘴唇保护剂
6)胶原蛋白生产
7)免疫和循环系统改善
8)皮肤损伤愈合
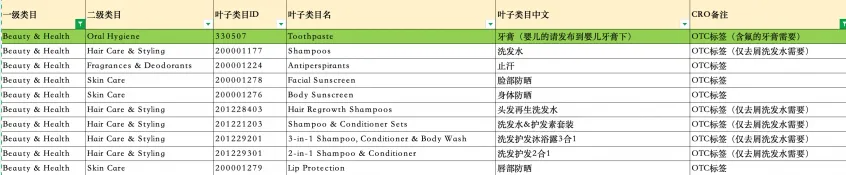
属于OTC范畴的“功能型化妆品”的类目参考表:
Q:售卖普通化妆品和OTC范畴下的“功能型化妆品”需要上传哪些资质?
A:
普通化妆品资质要求
资质要求
美国FDA化妆品企业+产品注册或签章的小型企业豁免承诺函
US标签要求
1. 普通化妆品标签要求:
1) 成分表
2) 身份声明:制造商、包装商或分销商的名称和营业地点
· 标明原产国的英文名称(如made in China)
3) 警告声明(针对部分商品)
4) 不良事件报告联系方式:美国地址、美国电话号码或电子联系信息,其中可能包括一个网站,通过该网站,责任人可以收到有关该化妆品的不良事件报告。
5) 芳香过敏原:责任人应在化妆品标签上标明该化妆品所含的每一种芳香过敏原。
6) 专业化妆品:标签还必须清楚显著地表明”该产品仅由获得许可的专业人士管理或使用”。
7)净含量说明: 根据21 CFR701.10,产品要以重量、尺寸、数量或数量与重量或尺寸的组合形式准确说明包装中化妆品的净含量。声明必须清晰可见,放置在面板的底部区域,与包装所在的底座大致平行,并且字体大小与法规规定的容器尺寸相称。固体、半固体或粘性化妆品的净含量声明必须以常量磅和盎司为单位,液体计量声明必须以美制加仑(231 立方英寸)和夸脱、品脱和盎司为单位。液量盎司的细分,如果内容物的净含量为一磅或一品脱或更多,则必须以盎司表示,并在括号 () 中声明最大的整体单位(即磅和盎司或夸脱和品脱和盎司)。内容物的净含量还可以用公制的重量或尺寸来表示。
平台管控方式
商家需在2024年7月1日之前上传相关资质,若未上传满足法规要求的资质,则执行相关商品美国屏蔽。
OTC范畴“功能型化妆品”的资质要求
资质要求
美国FDA化妆品企业+产品注册,美国OTC的企业+产品注册,美国的GMP证书(平台标准待输入)
US标签要求
除了上述基础标签要求信息外(详见上表),还需要增加drug fact模块:
1)必须标注“drug facts”
2)活性成分
3)必须标注使用名和注意事项
4)警告声明
drug fact模块示例图:
平台管控方式
商家需在2024年7月1日之前上传相关资质,若未上传满足法规要求的资质,则执行相关商品美国屏蔽。
Q:如果商家既售卖“普通化妆品”,又售卖“OTC范畴下功能型化妆品”,需要完成哪些注册? A
如果一个商家同时售卖”普通化妆品“和“OTC范畴下功能型化妆品”,那么这个企业需要同时做化妆品的企业注册,和药品(OTC)的企业注册,同时要分别完成商品列名注册。
商品列名注册要求:
每一个SKU都要列名(唯一的NDC号码)
一个列名包括:
1)药品标签,
2)药品成分的描述,
3)市场销售范畴,
4)表明其制造商和品牌持有者。
Q:如果化妆品企业不做FDA企业注册和商品注册,会面临什么后果? A
如果化妆品出口企业未按照美国食品药品监督管理局(FDA)的要求进行注册,可能会面临以下后果:
1)禁止进入美国市场:未注册的化妆品可能会被禁止进入美国市场。FDA要求所有进口的化妆品经过注册和备案,以确保其符合美国的安全和质量标准。如果企业未按要求进行注册,其化妆品可能无法获得批准进入美国市场。
2)法律责任和罚款:未按照FDA要求注册的企业可能面临法律责任和罚款。根据美国联邦法律,未经注册的化妆品被视为违反了法规,并可能受到相应的法律制裁。
3)品牌声誉受损:未按照FDA要求注册的企业可能会受到消费者和市场的负面影响。消费者普遍关注化妆品的安全性和质量,如果企业未进行注册,可能被认为不重视产品安全和合规性,从而损害品牌声誉。
Q:普通化妆品的US外包装标签要求: A
普通化妆品标签要求:
成分表
身份声明:制造商、包装商或分销商的名称和营业地点
标明原产国的英文名称(如made in China)
警告声明(针对部分商品)
不良事件报告联系方式:美国地址、美国电话号码或电子联系信息,其中可能包括一个网站,通过该网站,责任人可以收到有关该化妆品的不良事件报告。
专业化妆品:标签还必须清楚显著地表明”该产品仅由获得许可的专业人士管理或使用”
建议:因US装标签要求和欧盟标签基本一致,建议可在原欧盟英文标签上添加美国的联系方式,降低成本。
Q:OTC范畴“功能型化妆品”的US外包装特殊标签要求: A
除了符合普通化妆品的基础标签要求外,还需要增加drug fact模块:
1)必须标注“drug facts”
2)活性成分
3)必须标注使用名和注意事项
4)警告声明
OTC类drug fact模块示例图:
Q:经营化妆品的贸易商是否需要做FDA注册?
A:
贸易商不需要做化妆品FDA企业注册,但如果贸易商为品牌商,出口的品牌商品销往美国,则需要做化妆品FDA商品注册列名。
Q:OEM化妆品生产商是否需要做FDA注册及商品列名?
A:
OEM生产商需要做FDA企业注册,不需要做化妆品FDA商品注册列名,但需要引导OEM的品牌商做化妆品FDA商品注册列名。
Q:同类化妆品商品是否可做一个FDA商品列名注册?
A:
多个颜色或不同香味,不同容量的商品可做一个FDA商品注册列名。
Q:化妆品注册FDA及产品列名是否都需要美代?
A:
需要。
Q:商家既不是化妆品品牌方,也不是生产商,是否不需要做FDA注册及商品列名?这种情况下商家在速卖通销售需要满足什么条件?
A:
这种情况下商家不需要做FDA企业注册和FDA商品列名注册,但需要其合作的生产企业做FDA企业注册,同时提醒其进口的品牌方做FDA商品列名。商家需要满足化妆品贸易型企业要求的资质。
以上内容来源全球速卖通。